Un nuevo avance en retrovirus endógenos humanos puede abrir la puerta a nuevos tratamientos contra el cáncer
Un equipo de investigadores del Instituto de Inmunología de La Jolla de San Diego (Estados Unidos) ha revelado la primera estructura tridimensional de una proteína "clave" del retrovirus K endógeno humano (HERV-K), lo que marca un "hito" en la biología estructural y que abre la puerta a nuevas estrategias para el diagnóstico y el tratamiento de diversas enfermedades, como el cáncer.
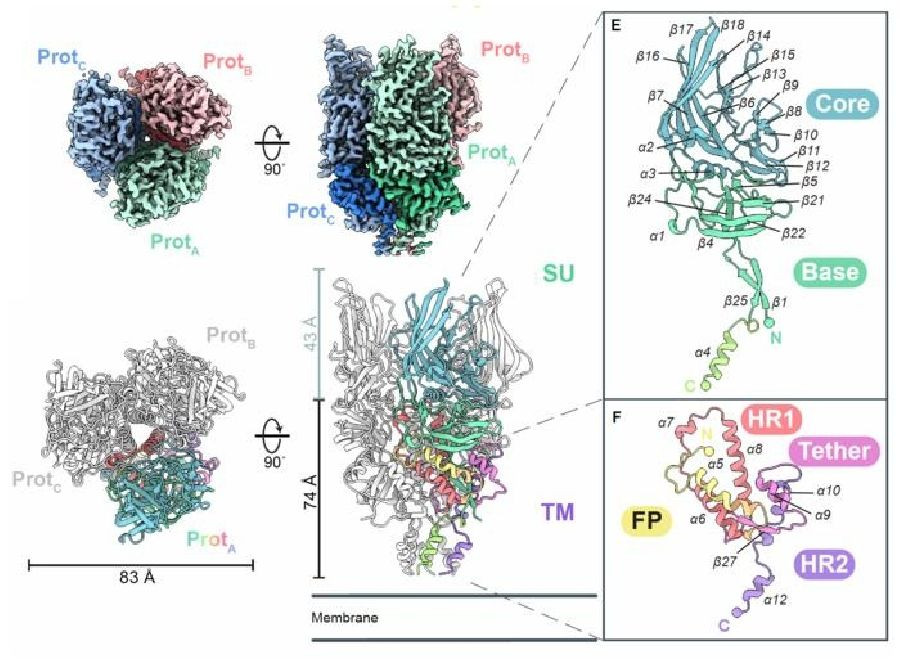
El estudio, publicado en la revista `Science Advances`, ha consistido en el mapeo de la glicoproteína de la envoltura superficial (Env), la diana de los anticuerpos del retrovirus endógenos humanos (HERV) más activo.
"Esta es la primera estructura proteica del HERV humano resuelta hasta la fecha, y solo la tercera estructura de la envoltura retroviral resuelta en general, después del virus de la inmunodeficiencia humana (VIH) y el virus de la inmunodeficiencia simia (VIS)", ha afirmado la presidenta, directora ejecutiva y profesora del Instituto de Inmunología de La Jolla, Erica Ollmann Saphire.
Cabe destacar que los retrovirus son remanentes de infecciones del pasado evolutivo del ser humano, y comprenden aproximadamente el 8 por ciento del genoma humano. Si bien en el pasado las proteínas Env de HERV-K se encontraban en la superficie de estos retrovirus, en los humanos modernos aparecen en la superficie de ciertas células tumorales y en pacientes con enfermedades autoinmunes y neurodegenerativas.
Los científicos han señalado que comprender la estructura de esta proteína, así como la forma en las que los anticuerpos la atacan, podría servir para el desarrollo de herramientas de diagnóstico o nuevas terapias, y es que los anticuerpos contra HERV podrían servir para distinguir las células cancerosas de las sanas.
"En muchas enfermedades, como las autoinmunes y el cáncer, estos genes se reactivan y comienzan a producir fragmentos de estos virus (...) Comprender la estructura de la enzima HERV-K y los anticuerpos que tenemos ahora abre nuevas posibilidades de diagnóstico y tratamiento", ha explicado el coautor principal del estudio, Jeremy Shek, investigador posdoctoral en el centro.
Tras ello, ha mostrado la posibilidad futura de desarrollar inmunoterapias contra el cáncer centradas en la Env de HERV-K para rastrear las células tumorales, de forma que se puedan atacar de forma específica.
PRESENCIA DE ENV EN ENFERMEDADES AUTOINMUNES
Esta proteína también se encuentra en las células de las personas con enfermedades autoinmunes, tales como el lupus o la artritis reumatoide, lo que puede deberse a que las células inmunitarias de los pacientes detectan estas proteínas extrañas y creen que el cuerpo está siendo atacado, por lo que se comienza a producir anticuerpos contra estas proteínas.
Es por ello por lo que el equipo investigador ha creado su propio panel de anticuerpos, en un intento de revelar cómo el sistema inmunitario puede atacar las diferentes subunidades de la molécula en todas sus formas, pues comprender cómo funcionan los ataques de los anticuerpos podría permitir una intervención encaminada a detener la inflamación dañina.
Los investigadores también han probado usar los anticuerpos para diagnosticar enfermedades autoinmunes, logrando detectar rápidamente la enzima HERV-K en los neutrófilos, un tipo de célula inmunitaria que puede causar inflamación, en pacientes con artritis reumatoide y lupus.
DIFÍCILES DE DETECTAR
Hasta ahora, las proteínas HERV habían sido "invisibles" por ser "demasiado móviles y espasmódicas" como para ser detectadas incluso con las técnicas de imagen más sofisticadas, por lo que resolver la estructura de Env ha sido "especialmente difícil".
Estas proteínas están llenas de "energía potencial" y están preparadas para fusionarse con una célula huésped e iniciar el proceso de infección, lo que significa que las proteínas de prefusión son propensas a cambiar espontáneamente a su estado posterior, el de posfusión.
"Puedes observarlas de forma extraña y se desdoblarán", ha subrayado Shek, quien ha explicado que para estudiar la estructura tridimensional de la proteína Env de HERV-K se han introducido pequeñas sustituciones para fijar la estructura de la proteína, conservando al mismo tiempo su forma natural.
Con ello, también han descubierto y han logrado caracterizar anticuerpos específicos que ayudaron a anclar diferentes versiones de las proteínas virales. Tras estabilizar sus estructuras, se ha usado una técnica de imágenes de alta resolución, conocida como microscopía crioelectrónica, para capturar imágenes en 3D de HERV-K Env en la superficie celular, en el acto de impulsar la infección y cuando se une a los anticuerpos.
Aunque muchas glicoproteínas de la envoltura viral presentan una estructura de trímero, la Env de HERV-K es diferente a todo lo observado hasta ahora, incluyendo los trímeros de otros retrovirus, y es que, a diferencia de los trímeros "más cortos y rechonchos" producidos por el VIH y el VIS, la Env de HERV-K es alta y delgada, y su plegamiento es diferente al de cualquier otro retrovirus.





























Sé el primero en comentar